IB Chemistry HL: Part 1
Chapter 1, 2, 3, 4 입니다.
무엇을 배울까요?
IB Chemistry의 1~4 단원
1. Stoichiometry
2. Atomic Structure
3. Periodicity
4. Bonding
커리큘럼
-
1.1.1 Classification of Matter1:11:21
-
1.1.2 Five main types of chemical reactions39:37
-
무료 수업 42:41
-
1.2.1 Mole 1: mole to particles40:12
-
1.2.2 Mole 2: balancing chemical equation23:56
-
1.2.3 Mole 3: mole to mass36:24
-
1.2.4 Mole 4: mole to volume of gas35:28
-
1.2.5 Mole 5: mole to concentration40:06
-
1.2.6 Mole 6: dilution27:11
-
1.2.7 Mole 7: Titration35:35
-
1.2.8 Mole 8: Back Titration33:38
-
1.2.9 Limiting reactant, Excess reactant, Yield36:52
-
1.3.1 Empirical & Molecular formula22:32
-
1.3.2 Determining empirical formula 1: Using mass percentage composition26:54
-
1.3.3 Determining empirical formula 2: Combustion analysis28:05
-
2.1.1 Atomic Structure37:11
-
2.1.2 Isotope48:11
-
2.1.3 History of Atomic models11:07
-
2.2.1 Bohr's model of Hydrogen atom1:17:20
-
2.2.2 Electronic Configuration1:07:50
-
2.2.3 Electronic Configuration Q&A18:47
-
3.1.1 Composition of periodic table43:11
-
3.1.2 Metal and Nonmetal, Melting & Boiling point across period27:56
-
3.2.1 Seven Periodic Trend 1: Effective Nuclear Charge & Shielding Effect46:23
-
3.2.2 Seven Periodic Trend 2: Electronegativity34:33
-
3.2.3 Seven Periodic Trend 3: Atomic & Ionic Radius49:56
-
3.2.4 Seven Periodic Trend 4: Ionization Energy 11:14:29
-
3.2.5 Seven Periodic Trend 4: Ionization Energy 238:00
-
3.2.6 Seven Periodic Trend 5: Electron Affinity, Metallic character, Nonmetallic character31:22
-
3.2.7 Acid-Base Characteristic of Period 3 Oxide & Acid Rain51:42
-
13.1.1 Transition metal core: Physical & Chemical properties of transition metal17:59
-
13.1.2 Transition metal core: Atomic radius of transition metals11:26
-
13.1.3 Transition metal core: Variable oxidation state24:01
-
13.1.4 Chemical property: Metal Complex 134:06
-
13.1.5 Chemical property: Metal Complex 213:24
-
13.1.6 Transition metal: Catalyst21:52
-
4.1.1 Ionic bond 1: Formation and Strength of Ionic Bond1:08:16
-
4.1.2 Ionic bond 2: Structure and Properties of Ionic Compound45:53
-
4.1.3 Ionic bond 3: Naming of Ionic Compound20:21
-
4.3.1 Covalent bond 1: Formation of covalent bond18:44
-
4.3.2 Lewis structure 1: Drawing Lewis structure59:44
-
4.3.3 Lewis structure 2: Resonance structure30:44
-
4.3.4 Covalent bond 2: Dative(coordinate) covalent bond33:16
-
4.3.5 VSEPR Theory (SL)48:28
-
4.3.6 VSEPR Theory (HL)36:56
-
4.3.7 Polarity of covalent Bond & covalent Molecule1:07:16
-
4.3.8 Structure and properties of covalent molecule15:38
-
4.3.9 Giant covalent molecule49:20
-
4.3.10 Nomenclature of covalent molecule12:57
-
4.4.1 London Dispersion Force49:34
-
4.4.2 Dipole-Dipole44:25
-
4.4.3 Hydrogen bond1:17:29
-
4.4.4 Naming Organic Molecules21:09
-
10.1.1 Nomenclature 1: Identifying Longest Carbon Chain38:57
-
10.1.2 Nomenclature 2: Identifying Main Functional Group1:13:18
-
10.1.3 Nomenclature 3: Identifying Substituent Group28:47
-
14.1.1 Hybridization of Orbitals37:43
-
14.1.2 Covalent Bond Type: Sigma bond & Pi bond29:31
설명
이재훈 선생님의 IB Chemistry (HL) 강좌입니다.
다루는 단원은 Chapter 1~4 입니다. (SL과 HL 포함)
*이재훈 선생님의 강좌는 각 단원별 기본 문제풀이도 포함되어 있습니다!
*얼라이언스 에듀의 모든 IB 과목의 HL 과정 강좌는 SL 내용을 포함하고 있습니다!
일시정지 기간: 10일 1회
교재 다운받는 방법:
인강 수강 시에 선생님의 핵심 노하우가 담긴 필기용 교재를 학생분께 PDF로 드립니다.
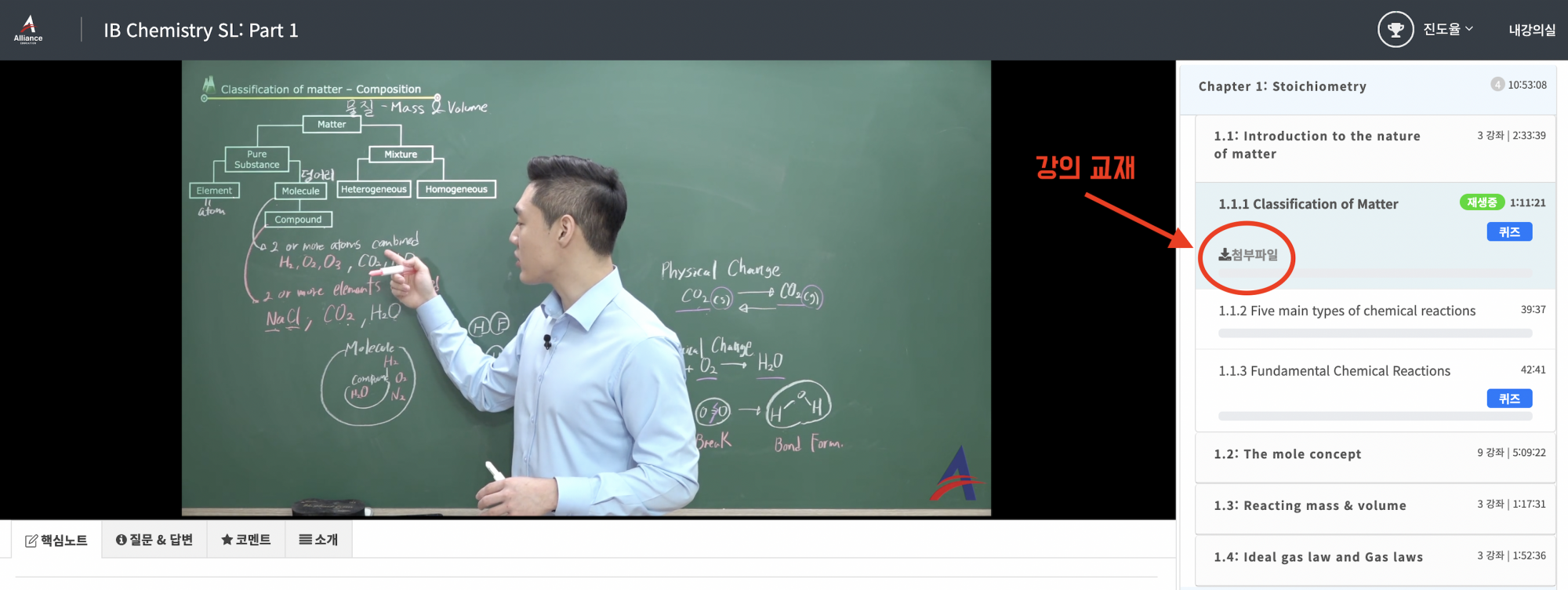
1) 인강 결제 후에 왼쪽 상단에 있는 "내 강의실"에서 구매한 강의를 누르면 아래 사진과 같은 수강 페이지가 보이게 됩니다.
2) 각 단원의 첫 번째 영상을 보면 "첨부파일" 버튼이 있는데, 이를 누르면 PDF가 열려서 다운이 가능합니다^^
질문하기 방법:
인강 수강 시에 강의에서 궁금한 내용을 올리시면 다음날 까지는 답변을 드려요~
선생님의 빠르고 정확한 답변을 위해 학생분들은 아래 형식을 꼭 지켜주세요!
1. 궁금한 부분의 강의 영상 번호 (1.1.1)
2. 강의 영상의 시간
3. 궁금한 내용을 구체적으로!

강사 평점
★★★★★ 5.0
코멘트



