|
안녕하세요 여러분!
이재훈 IB/AP 화학 선생님이에요~ 이번에 학생들 시험을 준비시키다가 좀 충격적인 내용을 보았어요. 방학동안 다른 학원에서 공부하다가 Stoichiometry의 Titration 내용을 너무 잘못 배웠더라고요. 상업적인 부분을 떠나서, 이렇게 가르친다는게 교육자로서 실망스러웠고 학생들은 그게 왜 잘못됬는지 모르는 상태로 점수가 깍이는게 속상하더라고요. 물론 그렇지 않은 선생님들도 많을거라 믿어요. 학생분들은 이 글을 읽고 이런 부분은 조심하면 좋겠어서 적어보아요. Titration이라는 것은 실험.방법 이에요! 예를 들어서, 우리가 HCl solution이 있다고 할게요. 그런데 concentration을 몰라! 그러면 나는 이 HCl solution의 concentration을 구하고 싶겠죠?? (아닌가??ㅎㅎ) 그래서 얘를 flask에 넣어서 실험으로 concentration을 구하는게 바로 titration이라는 실험의 목적입니다. .jpg?type=w773) 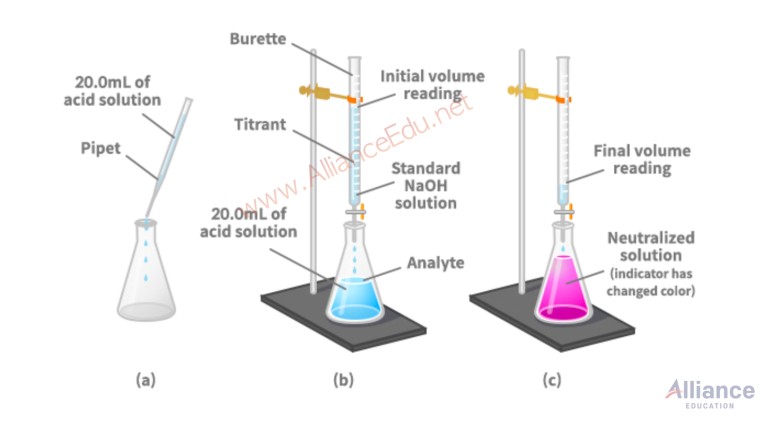 출처: 이재훈 선생님 교재 사진 출처: 이재훈 선생님 교재 사진
(그림도 직접 제작했는데 예쁘죠? ㅎㅎ) 그래서 HCl 20mL를 플라스크에 넣었는데 (파랑색 solution), 얘의 concentration을 Analyze 하고 싶으니까 Analyte라고 불러요. (Analyze = Analyte, 라임 좀 살렸죠) 그러면 이 analyte와 화학 반응을 하는 다른 solution을 위에서 떨어트리며 titration 실험을 하는거라 이 떨어트리는 녀석을 Titrant라고 불러요. 그리고 이 Titrant는 concentration을 알고 있는 상황이에요! 주로 Analyte가 Acid이니까 Titrant는 Base에요. (아니면 반대도 가능!!) 그러면 이 titrant를 언제까지 떨어트리냐? 색이 핑크색으로 바뀔 때 까지라고 주로 알고 있죠? 이때를 뭐라고 부르냐면 Equivalence Point라고 부릅니다. (매우 중요) 그러면 Equivalence Point의 뜻이 뭐냐?? Equivalence point는 "Analyte와 Titrant가 완벽하게 반응을 해서 모두 없어졌을 때"라고 봅니다. 그러면 우리의 analyte가 HCl이고 titrant가 NaOH라고 하면 아래처럼 반응할거에요. HCl + NaOH --> NaCl + H2O 보시면 알겠지만 HCl과 NaOH가 1대1로 반응하는걸 알 수 있죠? 그러면 NaOH를 위에서 10mol을 떨어뜨렸다면, 그리고 이때 모든 HCl과 NaOH가 reacted away했다고 본다면, HCl이 10mol 있었다고 볼 수 있는거에요. 여기까지는 모두 공부했을거라 믿어요!! 그러면 계산 방법은 이렇게 되겠죠. 1. moles of Titrant = Conc. of Titrant X Vol. of Titrant 2. Balanced Equation (꼭 적고) moles of Analyte = moles of Titrant X mole ratio 3. Conc. of Analyte = moles of Analyte / Initial Vol. of Analyte 저는 무조건 이렇게 3 step calculation으로 가르쳐요. 그런데 왠걸, MaVa = MbVb 라는 식을 덜렁 가르쳐주고 끝내는거 있죠? (a는 acid, b는 base, 혹은 각각 analyte와 titrant) 학생분은 여기가 매우 중요하고, 제가 여기서 실망한 부분이에요. 절대로!! 이 식을 쓰지 마세요. 이 식은 문제가 있습니다. 첫 번째 문제: Dilution에서 배우는 M1V1 = M2V2 와 굉장히 비슷하게 생겨서 학생들이 매우 햇갈릴 수 있음! 두 번째 문제: MaVa = MbVb 식은 특수한 경우에만 사용될 수 있음! 즉 언제만 사용 가능한지를 모른다면, 문제를 풀 때 틀릴 가능성이 굉장히 높아진다는 사실! 특수한 경우가 언제냐? 바로 Analyte와 Titrant가 1:1 비율로 react할 때만 입니다. 1. moles of Titrant = Conc. of Titrant X Vol. of Titrant 2. moles of Analyte = moles of Titrant X 1/1 3. Conc. of Analyte = moles of Analyte / Initial Vol. of Analyte 2번 step에서 어차피 1/1의 ratio를 곱해주니까 moles of Titrant = moles of Analyte가 성립하고, 그래서 Conc. of Titrant X Vol. of Titrant = Conc. of Analyte X Vol. of Analyte MaVa = MbVb 가 되는 것이에요. 즉, 위에서 다룬 HCl과 NaOH는 1:1로 반응하기 때문에 2번 step에서 곱해주는 mole ratio가 어차피 1:1이에요. 하지만 항상 이런거는 절대로 아니죠! 예를 들어서, H2SO4 + 2 NaOH --> Na2SO4 + 2H2O 처럼 1:2 비율로 반응하면 2번에서 1:2를 곱해줘야되요. 그러면 10mol의 NaOH를 떨어뜨렸다면 5 mol의 H2SO4가 있었다는 뜻이거든요. 위의 잘못된 방식으로 계산해버리면 10 mol의 H2SO4가 있다고 틀린 계산이 되는거에요. 그러니까 꼭 꼭 알고 사용하세요 여러분. 무조건, 제가 위에다 적은 3 step calculation을 통해서 접근하시기 바랍니다. 왜냐? 이거는 제가 여러분을 길들이기 위한 부분도 있어요. (갑자기 왠 길들임??) 들어보세요. 그 이유는, 앞으로 여러분이 Acid & Base 단원을 공부할 때 titration이 훨~~씬 깊게 나온답니다. 여기서 포기하는 학생이 진짜 많아요. 그 이유는 무엇 때문에? 위에서 말씀드린 titration 계산을 처음부터 제대로 배우지 못했기 때문이에요. 그러니까 please please!! 처음 배울 때 부터 길을 제대로 알고 공부합시다 여러분! 그러면 오늘은 여기까지!! 뿅 이재훈 선생님 블로그: https://blog.naver.com/ibapchemistry |